Über Plusultra pharma
As a research and development-based pharmaceutical company, we develop pharmaceuticals for unmet needs, such as orphan drugs. Before delivering new products, we always consider the needs of our customers.
Corporate Mission
Contribute to Society by Providing Critical but Neglected Pharmaceuticals and Medical Devices
Management Policies
General
- Give priority to legal and ethical compliance in the course of business – never prioritize loyalty to company over moral.
- Share our Mission, Policies and Code of Conduct among all stakeholders (employees, shareholders, officers).
- Pursue evolution of the company, yet becoming larger is not our main goal.
- Comply with regulations and ethical codes.
- Ensure transparency and disclosure.
- Launch business overseas.
Personnel
- Value employees and families, and respect self-development.
- Employ the principle of “select few”*, and create an environment where they can enjoy working.
*Select few = experienced experts passionately devoted to working, irrespective of gender, age, nationality, religion or preference. - Value suggestions and opinions from employees.
Products
- Pursue high-quality products and data.
- Ensure post-marketing safety.
- Search for product seeds externally.
Capital
- Profits are a result of and means of achieving the Mission.
- Focus on higher return on sales/profits per employee.
- Keep in mind the disadvantages of failure – not the assumption of success – when making investment decisions.
- Profits are distributed to shareholders (dividends*), employees**, and to internal reserves.
*Dividends: 1/3 of profits after tax
**employees: up to dividends - Invest asset only with a principal guarantee.
Direction
Putting ourselves in the position of people who look forward to our research progress as a research and development-based pharmaceutical company, develop pharmaceuticals for unmet needs, such as orphan drugs (for rare diseases), off-label drugs, and drugs for intractable diseases, and facilitate quick delivery of these drugs to patients and physicians in need.
Code of Conduct
Principle
When in doubt, the patient benefit takes priority.
Our Challenges
- YMWS: “Yatte Minakucha Wakaranai, shikashi Songiri wo tamerauna”
= You never know how it will turn out unless you try, but do not hesitate to cut losses - ZY: “Zenrei ga nainara Yattemiru” = Even if there is no precedent, be the first to try it
Speed
- Never forget patients are waiting.
- Be unafraid to buy time.
- Set a specific deadline date* at the beginning to pursue the goal without worrying about possible delays.
*Stay away from “approximately/around” and “early/late”, etc. - If problems or mistakes occur, prevent their expansion first before preventing reoccurrence.
- Speedy decisions by managers who have authority of million(s) yen projects*.
*3 million for Division Manager; 1 million for Department/Branch Manager/PM/PL
Cost/Efficiency
- Never take or lead to wasteful actions.
- No overtime work is considered optimal.
- Consider patient needs, scientific rationality and laws/regulations when pursuing higher quality in products/data.
- Pursue cost reduction with the principle of multiple sources, while regarding providers as partners.
Communications/Relationship
- Embrace inter-departmental advice and cooperation – hiding in silos is a symptom of “Big Company” Disease.
- Superiors to confidently entrust tasks to subordinates, but never leave unmanaged.
- Hear anyone out – never interrupt in the middle.
- Start with conclusion/result when explaining/responding.
- Greetings may seem small, but they are important.
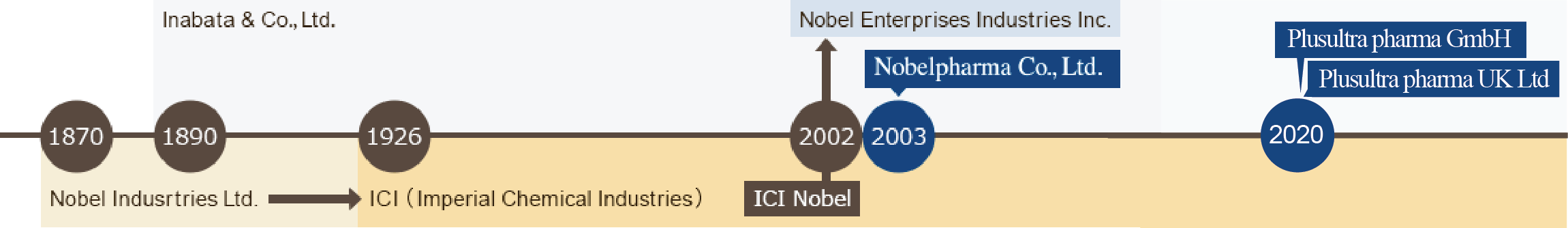
Die Familienline der Nobelsl
Nobel, der für die Erfindung des Dynamits bekannt ist, hat im Jahre 1870 die Firma Nobel Industries Limited gergründet. Durch von Zukäufen begründete Diversifikation ist daraus das weltweit führende Unternehmen ICI (Imperial Chemical Industries) entstanden – deren Geschäftsbereich, die ICI Nobel dann im Jahre 2002 zur heutigen current Nobel Enterprises Industries Inc. wurde, als sie von Inabata & Co., Ltd. aufgekauft wurde. In dieses Unternehmen wurde, als Teil der Unternehmensgruppe, unsere Firma Nobelpharma Co., Ltd. eingegliedert.
Stolz darauf, den ehrwürdigen Namen Nobel zu übernehmen, fühlen wir uns verpflichtet der Gesellschaft etwas beizusteuern, indem wir Pharmazeutika und medizinische Geräte anbieten, welche nur wir zur Verfügung stellen können.
In 2020 wurden Übersee auf dem europäischen Kontinent unsere Tochtergesellschaften Plusultra pharma GmbH und Plusultra pharma UK Ltd. in Düsseldorf, Deutschland, und Oxford, Vereinigtes Königreich, gegründet, welche unser Andenken an die Familie Nobel weiterführen.
- Am 15. Mai 2023 erteilte die Europäische Arzneimittel-Agentur EMA der Plusultra pharma GmbH die Genehmigung für das Inverkehrbringen des Arzneimittels Hyftor 2 mg/g Gel (Sirolimus), für die Behandlung von Angiofibromen des Gesichts in Verbindung mit tuberöser Sklerose (TSC: Tuberous Sclerosis Complex) bei Erwachsenen, Kindern und Jugendlichen von 6 Jahren und älter.
- Am 15. Mai 2023 bestätigte die European Medicines Agency (EMA) den Orphan Drug Status für Hyftor® 2 mg/g Gel (Sirolimus) zur Behandlung der tuberösen Sklerose (gutartige Hauttumore im Gesicht; faziale Angiofibrome). Orphan Maintenance Assessment Report (europa.eu)
- Am 23. Februar 2023 gab der Ausschuss für Humanarzneimittel (CHMP: Committee for Medicinal Products for Human Use) eine positive Stellungnahme ab. Der Ausschuss empfiehlt die Erteilung einer Genehmigung für das Inverkehrbringen des Arzneimittels Hyftor, für die Behandlung von Angiofibromen des Gesichts in Verbindung mit tuberöser Sklerose (TSC: Tuberous Sclerosis Complex) bei Erwachsenen und pädiatrischen Patienten von 6 Jahren und älter.
